Microbiote intestinal : l’organe endocrinien méconnu
Le microbiote
2 juin 2024
Cet article explore comment le microbiote intestinal agit comme un organe endocrine en examinant son développement, sa structure, et sa fonction. Il analyse également comment ce microbiote régule le métabolisme du glucose, l’obésité, le système de stress, et influence le cerveau et le comportement, avec des implications pour la santé et la maladie.
Qu’est un organe endocrine ?
C’est un organe qui produit et régule de nombreux composés qui atteignent la circulation sanguine et influencent le fonctionnement d’organes éloignés. Comme les ovaires, la thyroïde, les glandes surrénales, le pancréas… le microbiote produit des hormones qui ont des effets dans le reste du corps : c’est en ce sens un organe qui fait partie du système endocrinien.
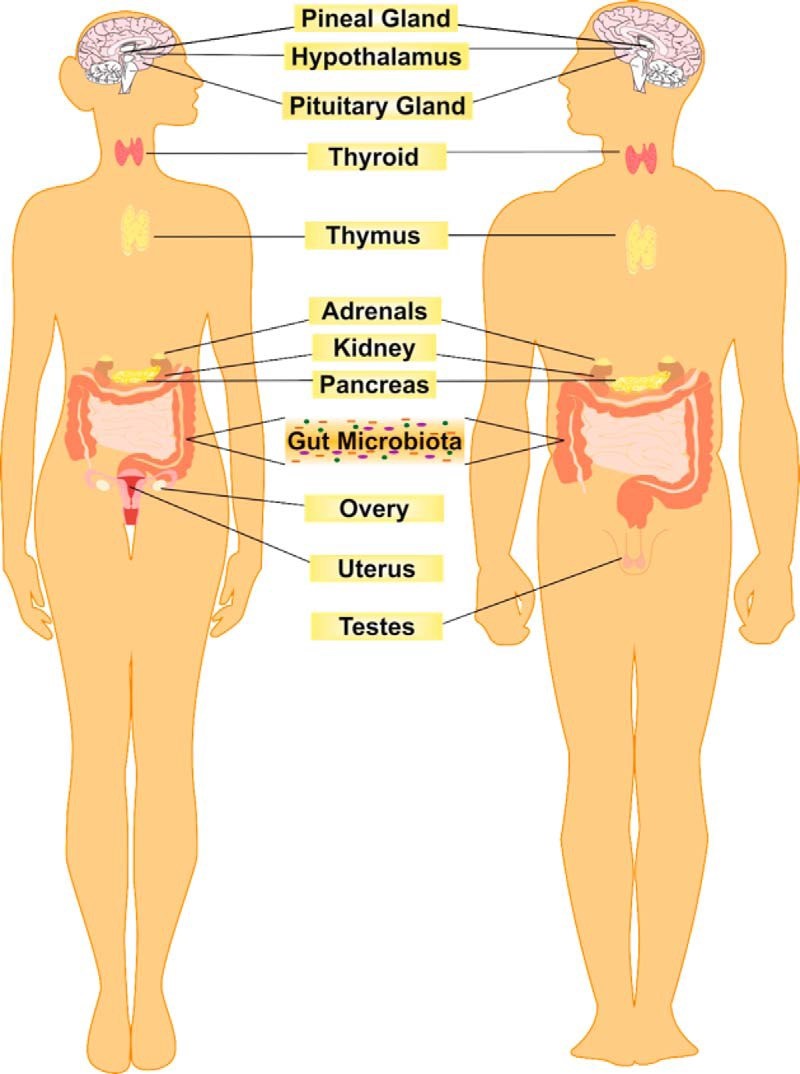
Le microbiote intestinal: un organe complexe
Contrairement aux autres systèmes endocriniens ou organes qui sécrètent un seul ou un petit nombre de substances, le microbiote intestinal a le potentiel de produire des centaines de produits. En fait, la complexité biochimique du microbiote intestinal dépasse même celle du cerveau, et de nombreuses hormones produites par le microbiote sont également des neurotransmetteurs du système nerveux central (SNC). Par exemple, le GABA, le principal neurotransmetteur inhibiteur du cerveau, est produit par plusieurs lactobacilles, tandis que la noradrénaline, la dopamine et la sérotonine sont également produites par certaines souches de bactéries (voir la table ci-après).
| Classe | Exemples | Fonctions |
| Acides gras à chaîne courte (AGCC) | Acétate | Source d’énergie |
| Butyrate | Régulation du métabolisme | |
| Propionate | Molécules de signalisation | |
| Neurotransmetteurs | Sérotonine | Humeur, émotion, cognition, récompense |
| Dopamine | Plaisir, bien-être | |
| Noradrénaline | Excitation, vigilance | |
| GABA | Inhibiteur de l’activité cérébrale | |
| Précurseurs de composés neuroactifs | Tryptophane | Précurseur de la sérotonine (et mélatonine) |
| Hormones de l’axe HPA | Cortisol | Réponse au stress |
| Régulation du métabolisme | ||
| Anti-inflammatoire | ||
| Cicatrisation | ||
| Hormones gastro-intestinales | Ghréline | Régulation du métabolisme |
| Leptine | Régulation de l’appétit |
Cette capacité biochimique provient de la vaste et diverse gamme de cellules microbiennes, pesant environ 1 à 2 kg chez un adulte moyen. Avec 50 000 milliards de cellules, le nombre de cellules microbiennes dépasse de loin le nombre de cellules de l’hôte, estimées entre 35 et 40 000 milliards. Saviez-vous qu’il existe au moins 40 000 espèces bactériennes dans notre microbiote ?
Voici une représentation simplifiée des passages des métabolites du microbiote dans le sang:
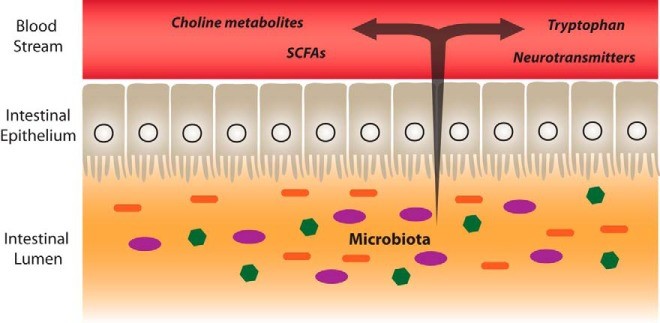
Microbiote et métabolisme de l’hôte
Comment le microbiote peut influer sur l’obésité, les maladies cardiovasculaires, et les syndromes métaboliques ? Et bien, la portée endocrine du microbiote intestinal s’exprime au travers de la régulation de la sensibilité à l’insuline, du stockage des graisses, de l’adiposité, de la faim, et du poids corporel.
Des études récentes ont montré que des souris sans germes deviennent obèses après avoir reçu un microbiote transplanté de souris obèses. Inversement, ces mêmes souris perdent du poids après avoir reçu un microbiote de souris ayant perdu rapidement du poids suite à une chirurgie bariatrique. Une autre étude a démontré que lorsque des souris ayant reçu le microbiote d’un jumeau obèse étaient cohabitées avec des souris ayant reçu le microbiote du jumeau maigre, le développement de l’augmentation de la masse corporelle et du profil métabolique associé à l’obésité était empêché, probablement en raison de l’invasion de bactéries spécifiques du microbiote du jumeau maigre.
Il semble donc probable que, dans certains cas d’obésité, le microbiote puisse être un facteur causal et une cible thérapeutique pour l’amélioration des symptômes. Cependant, il est important de reconnaître que l’obésité est probablement multifactorielle. Il est en effet important de prendre en compte les multiples facteurs potentiellement confondants tels que le régime alimentaire, l’âge, le degré d’obésité, la géographie démographique et la taille de la population.
Et comme nous allons le voir dans la suite de cet article, il existe un certain nombre de métabolites, soit produits soit régulés par le microbiote intestinal, qui pourraient aussi avoir un impact sur notre métabolisme en particulier et notre santé en général.
Métabolite du microbiote intestinal : focus sur les Acides Gras à Chaîne Courte
Les fibres alimentaires, lorsqu’elles arrivent dans l’intestin, sont fermentées par les bactéries du microbiote intestinal, produisant des monosaccharides, des gaz (comme le méthane et le gaz carbonique), et des acides gras à chaîne courte (AGCC) tels que le butyrate, l’acétate et le propionate. Ces AGCC, produits principalement dans le côlon et aussi dans l’intestin grêle, jouent un rôle crucial dans notre métabolisme énergétique.
Le butyrate est la principale source d’énergie des cellules des parois de nos intestins aidant à maintenir la perméabilité de l’intestin. Des études montrent qu’un déficit en AGCC augmente ainsi la perméabilité intestinale et la sécrétion de molécules pro-inflammatoires, conduisant à une inflammation de bas grade et à une résistance à l’insuline. Ces résultats, pour l’instant, sont basés sur des modèles animaux et doivent encore être confirmés chez l’homme.
Les AGCC contrôlent également le stockage des graisses et le métabolisme des acides gras dans l’intestin. Ils peuvent activer l’oxydation des acides gras et inhiber leur synthèse. Des études ont démontré qu’un déséquilibre du microbiote intestinal, avec une diminution de la production de butyrate, est lié au développement du syndrome métabolique, du diabète de type 2 et de l’obésité. Chez les rongeurs, des taux élevés d’AGCC sont associés à un phénotype mince, mais les résultats chez l’homme doivent encore être confirmés.
Les AGCC ont aussi des effets sur la faim. Le butyrate, par exemple, stimule la production de leptine, une hormone qui réduit l’appétit.
Un bon équilibre en acides gras à chaîne courte est donc essentiel pour la santé intestinale et il peut-être pertinent de tester votre profil en acides gras à chaîne courte. En testant votre profil des acides gras à chaîne courte, cela permettra a votre praticien de prendre des mesures nutritionnelles ciblées ainsi que des combinaisons avec des probiotiques spécifiques.
Métabolites du microbiote intestinal : focus sur les acides biliaires
Les acides biliaires primaires sont fabriqués à partir du cholestérol puis stockés dans la vésicule biliaire pour être libérés dans l’intestin au début des repas, facilitant ainsi la digestion et l’absorption des graisses. Après le repas, les acides biliaires présents dans la circulation sanguine sont transportés au foie et sécrétés à nouveau dans la bile : c’est le cycle entérohépatique. Durant ce cycle entérohépatique, les acides biliaires sont métabolisés (= fabriqués) par les enzymes bactériennes de l’intestin.
Des études récentes confirment le rôle crucial des acides biliaires dans la régulation du métabolisme. Les chercheurs ont prouvé que l’administration d’acides biliaires à des souris augmentait leur dépense énergétique, empêchant ainsi l’obésité et la résistance à l’insuline. Les souris nourries avec un régime très riche en graisses devenaient obèses, tandis que celles dont le régime était enrichi en acide cholique (un acide biliaire abondant) maintenaient un poids normal. De plus, l’ajout d’acides biliaires à l’alimentation de souris obèses leur a permis de revenir à un poids normal en 30 jours.
Ces résultats, confirmés en laboratoire sur des cellules humaines, suggèrent que les acides biliaires pourraient devenir une cible efficace pour traiter l’obésité et le diabète de type 2. Les conclusions de ces travaux ont été publiées dans la revue Nature le 8 janvier 2006.
Cette nouvelle voie de régulation de l’équilibre énergétique par les acides biliaires pourrait représenter une approche prometteuse pour traiter l’obésité et le diabète de type 2.
Les acides biliaires se testent aussi, à l’instar des acides gras à chaîne courte. Leur analyse permettra à votre praticien de déterminer de manière précise quels sont les acides biliaires en excès et/ou en déficit, de vous proposer un traitement individuel et de suivre l’évolution de ce traitement grâce à un contrôle du bilan.
Manipulation du microbiote intestinal : probiotiques & prébiotiques
Si la composition du microbiote intestinal change, alors la production hormonale devrait théoriquement être modifiée aussi. Cela semble être le cas lorsque la composition du microbiote est modifiée directement par des souches probiotiques ou indirectement par des prébiotiques, qui favorisent ensuite la croissance de certaines souches bénéfiques par rapport à d’autres. Les composés biochimiques spécifiques de ces souches peuvent alors augmenter la capacité endocrine du microbiote intestinal et agir comme des hormones pour influencer le métabolisme de l’hôte.
Bien que certaines études aient été menées sur les rats, il a été démontré que les probiotiques ont un pouvoir anti obésité. Certaines bactéries sont capables de réduire la taille des adipocytes (les cellules graisseuses). La bactérie L. plantarum KY1032 a démontré pouvoir entrainer une réduction de l’adipogenèse (la fabrication des cellules graisseuses). Sur les rats, la bactérie L. paracasei NCC2461 augmente la lipolyse (destruction de la graisse) de leurs tissus adipeux. La bactérie L. paracasei F19 réduit la graisse corporelle totale et entraine une diminution des niveaux de triglycérides (chez les souris, encore). L’administration de L. paracasei F19 et Lactobacillus acidophilus NCFB1748 aux souris élevées en milieu stérile a démontré entrainer un enrichissement des souches probiotiques et une régulation positive des hormones sensibilisant à l’insuline.
L’inuline ou les prébiotiques de type inuline, lorsqu’ils sont pris par voie orale, atteignent le côlon où ils subissent une fermentation bactérienne et stimulent la croissance des espèces de Bifidobacteria. Ces types de prébiotiques peuvent influencer la production d’hormones gastro-intestinales telles que la ghréline et la leptine. La ghréline, en particulier, a attiré beaucoup d’attention en tant qu’hormone de la faim. Cela permet au microbiote d’exercer une influence non seulement sur le métabolisme de l’hôte, mais aussi sur la prise alimentaire et la régulation de l’appétit.
Métabolites du microbiote intestinal : focus sur le tryptophane
Les niveaux de tryptophane dans le sang, un précurseur de la sérotonine (hormone 5-HT), semblent être régulés par le microbiote intestinal. La sérotonine est un neurotransmetteur important qui joue un rôle clé dans la communication entre l’intestin et le cerveau, tant dans le système nerveux de l’intestin que dans le système nerveux central.
La manière dont les bactéries intestinales contrôlent le tryptophane n’est pas entièrement comprise, mais elle pourrait impliquer une voie métabolique spécifique.
Les personnes atteintes du syndrome du côlon irritable (SCI) montrent une activité accrue de certaines enzymes qui dégradent le tryptophane, ce qui affecte leur santé intestinale et mentale. Les bactéries utilisent le tryptophane pour leur propre croissance ou pour produire d’autres composés bénéfiques.
En résumé, le microbiote intestinal aide à maintenir un équilibre de tryptophane, ce qui est essentiel pour la santé mentale et intestinale. Ces découvertes ouvrent des possibilités pour traiter des troubles comme le SCI en modifiant les bactéries intestinales.
Conclusion
Le microbiote a la capacité de produire une vaste gamme de composés qui jouent un rôle majeur dans la régulation de l’activité des organes distants, y compris le cerveau. L’influence du microbiote dans la régulation de l’activité métabolique est désormais reconnue, avec de plus en plus de preuves suggérant son implication dans la régulation du glucose et du poids. Des signatures microbiennes qui augmentent le risque de diabète et d’obésité ont été identifiées. De même, un rôle du microbiote dans la régulation de l’axe HPA a été établi.
Avec une meilleure compréhension des gènes clés du microbiote impliqués dans la régulation endocrine, il pourrait être possible d’utiliser des probiotiques ou d’autres moyens modulateurs comme les transplantations de microbiote fécal pour traiter ou prévenir le syndrome métabolique ou d’autres troubles comme ceux liés au stress.
Des tests fonctionnels existent et permettent de mieux comprendre et évaluer l’état du microbiote intestinal. Ces tests peuvent identifier les déséquilibres microbiens et aider à personnaliser des interventions thérapeutiques, telles que la mise en place d’un plan micronutritionnel individualisé, ou la préconisation de probiotiques et/ou de prébiotiques. Ces outils diagnostiques sont essentiels dans un parcours de santé fonctionnelle, offrant des stratégies ciblées pour améliorer la santé intestinale et globale des patients.
Si vous pensez qu’un parcours en santé fonctionnelle pourrait répondre à vos besoins, je vous invite à découvrir mes services.
Source de l’article : lien

L'une des premières étapes vers une alimentation plus consciente et plus saine est de reconnaître l'existence et l'impact des calories cachées. Ces intrus sournois se glissent dans notre alimentation quotidienne sous des formes inattendues !
Les 9 sources de calories cachées
téléchargement gratuit